急性冠状动脉综合征(ACS)是冠心病最严重的亚型之一,主要包括急性心肌梗死和不稳定型心绞痛。尽管在预防、诊断和治疗方面已有所进展,ACS仍然是中国和全球范围内的主要死因之一。目前,基因组学研究已经发现了多个与冠心病相关的遗传变异,但这些遗传标记通常无法解释环境因素对疾病的影响,且具体的调控机制尚不明确。DNA甲基化作为一种可逆的表观遗传修饰,能够整合环境因素和遗传易感性,在不改变DNA序列的情况下调节基因表达,因而成为探索ACS发病机制的新兴方向。它可以反映个体长期的生活方式和环境暴露,提供比遗传变异更为动态的疾病风险信息。已有研究表明,DNA甲基化的变化与ACS有重要关联,但由于现有研究大多为横断面设计,难以明确其与ACS间的因果关系。因此,明确DNA甲基化在ACS中的作用,对于揭示疾病的发病机制、发现新的预测预警标志物以及制定个性化预防和治疗策略具有重要意义。
2024年8月28日,华中科技大学邬堂春、王超龙教授与北京大学吕筠教授共同通讯在Nature Communications在线发表题为“Genome-wide DNA methylation profiling in blood reveals epigenetic signature of incident acute coronary syndrome”的研究论文,该研究通过在两个中国前瞻性队列——东风-同济(DFTJ)队列和中国慢性病前瞻性研究(CKB)队列中进行全表观基因组关联研究(EWAS),系统整合基因组、表观遗传组和转录组等多组学数据,揭示了DNA甲基化改变在ACS发病过程中起到关键作用以及具有更好的疾病风险预测能力。论文共同第一作者是华中科技大学的龙品品博士和北京大学的司佳卉博士。

文章要点
首先,研究人员在两个独立的中国前瞻性队列中进行了两阶段EWAS设计。发现阶段,研究人员基于DFTJ队列的751对ACS巢式病例-对照人群,对超过77万个DNA甲基化位点进行了全基因组DNA甲基化关联分析,鉴定出72个与新发ACS相关的差异甲基化位点(DMPs, FDR<0.05)。验证阶段,研究人员在CKB队列的476对ACS巢式病例-对照人群中对这些DMPs进行验证,最终确认了26个方向一致且显著相关的DMPs(见图1),其中有3个DMPs所在基因PRKCZ、PRDM16和EHBP1L1已知与心血管疾病有关,本研究进一步揭示了这些位点在ACS发生中的表观遗传调控机制。孟德尔随机化分析(MR)进一步证实了四个DMPs(位于PRKCZ、TRIM27、EMC2和EHBP1L1)与ACS的因果关系。
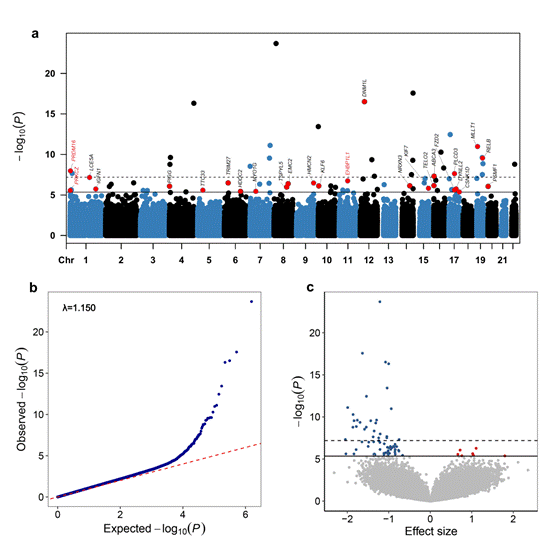
图1. 新发ACS的全表观基因组关联研究结果(东风-同济队列)
然后,研究人员通过表达数量性状甲基化分析(eQTM)评估了验证位点对基因表达的潜在调控能力,发现位于PIGG基因的cg03609847、位于HDDC2基因的cg12853539 和位于EHBP1L1基因的cg16749093位点在新发ACS组中均表现为低甲基化水平,并与其对应基因的表达水平呈显著负相关。进一步的多组织表达数据库分析表明,PIGG基因和EHBP1L1基因在ACS患者白细胞中的表达显著上调;其在动脉粥样硬化斑块中的表达显著高于正常动脉组织,或在晚期动脉粥样硬化组织中的表达显著高于早期动脉粥样硬化组织(见图2和图3)。这些一致的分析结果进一步支持了特定DNA甲基化位点在ACS发病机制中的调控作用,并为这些位点作为新的预防和治疗靶点提供了有力的科学证据。
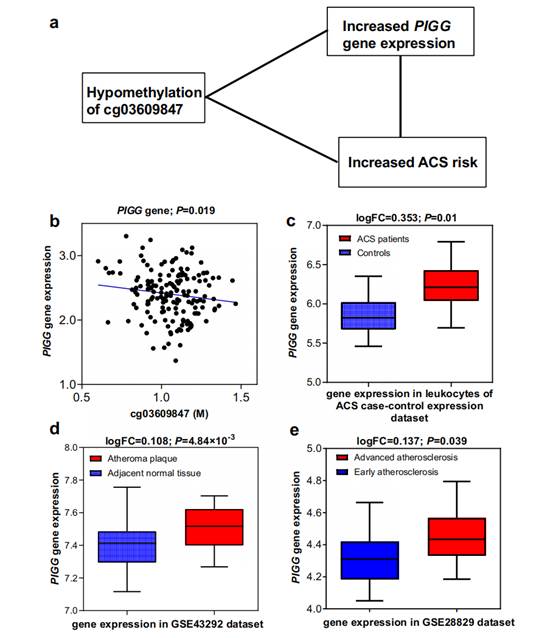
图2. cg03609847位点、PIGG基因表达与ACS风险之间的关联
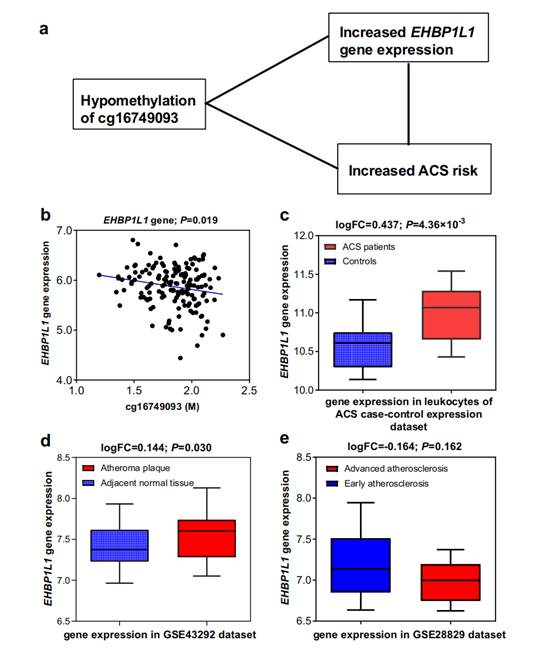
图3. cg16749093位点、EHBP1L1基因表达与ACS风险之间的关联
最后,研究团队还评估了这些DMPs在预测ACS风险中的临床应用价值,构建了一个基于67个DMPs的甲基化风险评分(MRS)。结果表明,MRS在两个人群中的预测表现均优于传统风险因素和多基因风险评分(PRS),进一步证明了DNA甲基化在疾病早期预测中的巨大潜力(见图4)。
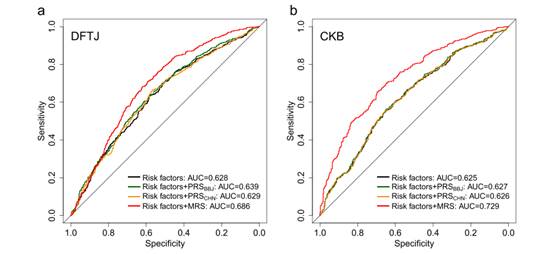
图4. 甲基化风险评分(MRS)、多基因风险评分(PRS)和传统风险因素对ACS风险预测能力的评估
结论与展望
本研究通过大规模的两阶段EWAS和系统的多组学整合分析,揭示了DNA甲基化在ACS发病机制中的关键作用,并展示了其在疾病预测中的重要应用潜力。这些发现为ACS的发病机制提供了新的表观遗传学证据,突显了DNA甲基化在预测、干预和治疗方面作为潜在生物标志物的可能性。此外,基于DMPs构建的MRS在ACS风险预测方面展现出显著的临床应用价值。未来的研究应在不同人群和动物模型中进一步验证这些发现,深入探讨其具体的生物学机制,从而为个性化医疗和早期干预策略提供更加坚实的证据。

